小编:医疗器械电子血压计 产品性能研究申报资料中应当包括产品性能研究资料以及产品技术要求的研究和编制说明,包括功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所
医疗器械电子血压计产品性能研究申报资料中应当包括产品性能研究资料以及产品技术要求的研究和编制说明,包括功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
应提交YY0670—2008中要求的系统整体的有效性研究资料。
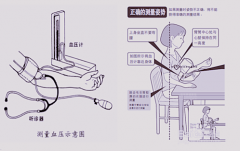
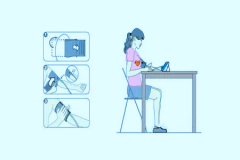
制造商应提供针对自动血压测量准确性的临床评估报告。推荐的临床评估方案:在这个临床过程中应确保被评估系统的整体性能的评价方法符合YY 0670—2008中第G.1章(听诊法)或第G.2章(有创法)的要求,而且符合标识要求,并确保整个体系在上述临床评价的统计结论应满足:
——按YY0670—2008中G.1.1的方法,达到平均差不超过±0.67kPa(±5mmHg),标准偏差不超过1.067kPa(8mmHg);
——按YY0670—2008中G.1.2的方法,达到G.1的要求。
详细方法和要求,请参见YY0670—2008附录G。
除YY0667—2008中的临床评估方案,本指导原则中推荐的其他临床评估方案也是可选的。
应描述所采用的国家标准标、行业标准中不适用条款的理由。
如有附加的产品功能(如脉率)及检测方法,给出其制定的相关的依据。
电子血压计软件研究
软件研究应参见《医疗器械软件注册技术审查指导原则》。制造商应提交一份单独的医疗器械产品软件描述文档,内容包括基本信息、实现过程和核心算法,详尽程度取决于软件的安全性级别和复杂程度。同时,应当出具关于软件版本命名规则的声明,明确软件版本的全部字段含义,确定软件的完整版本和发行所用的版本
生物相容性研究
生物相容性评价根据GB/T 16886.1标准进行,企业的申报资料应描述电子血压计所用材料及其与人体接触的性质,如:产品袖带(腕带)所采用的材料,与人体接触为直接接触。生物相容性评价研究应给出实施或豁免生物学试验的理由和论证,并对现有数据或试验结果进行评价。建议电子血压计与患者接触部件至少考虑以下方面的要求:细胞毒性0级(或依据ISO10993.5—2009Biological evaluation of medical devices -- Part 5: Tests for in vitro cytotoxicity不超过2级);应无迟发型超敏反应;皮肤刺激应不大于1级。
灭菌/微生物控制工艺研究
如产品声称具有无菌提供的部件,应提供灭菌工艺的研究资料。
使用次数和包装研究
使用次数的确定:应当提供产品寿命信息及确定依据。
电子血压计品牌排行包装及包装完整性:应当提供产品包装的信息及确定依据,如产品声称具有无菌提供的部件,应提供在宣称的有效期内以及运输条件下,保持包装完整性的依据。
当前网址:http://www.gjymw.com/a/dzxyj/2018/0803/186.html