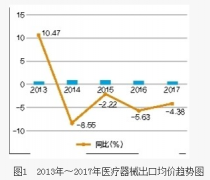
小编:医疗器械 行业,2015年国家食品药品监管总局组织人员对境外2家医疗器械生产企业进行了生产现场检查。2016年,共对8个国家19家医疗器械生产企业的33个品种进行了生产现场检查。201
医疗器械行业,2015年国家食品药品监管总局组织人员对境外2家医疗器械生产企业进行了生产现场检查。2016年,共对8个国家19家医疗器械生产企业的33个品种进行了生产现场检查。2017年,则对美国、德国、英国等10个国家的24家企业的46个产品(包括6个在审产品)实施了生产现场检查。2018年检查企业数量将达到30多家,检查力度逐年加大。
“从整个运作过程看,第一年是试点,所以选择了规模较大,技术、管理领先的强生和美敦力,主要是以学习经验和探索工作方式方法为主。第二年扩大了检查范围但并未公布检查结果,直到2017年底,才在总局网站上公布了境外生产现场检查结果,表明我国医疗器械境外检查工作已步入正轨。”国家食品药品监管总局食品药品审核查验中心(以下简称“核查中心”)医疗器械核查处处长王爱君表示,“2017年检查的24家企业的境外生产现场检查结果会陆续在网上公布,对于企业确实存在的违法违规行为,该处罚就处罚。”
而根据国家食品药品监管总局2016年12月9日印发的《医疗器械境外检查工作规范》,每年的11月30日前,国家食品药品监管总局完成下年度医疗器械境外检查年度计划的审核,包括年度检查品种的提出、确认、核准,召开被检查品种生产企业通气会等。核查中心根据产品类别特点选派具有资质的检查员,结合产品生产地域、检查时间等,拟定年度检查计划,报国家食品药品监管总局医疗器械监管司,经总局分管领导批准后,报总局国际合作司。
“凡是纳入年度检查计划的企业,要开通气会,确定产品具体在哪个国家、产品的具体生产状况等。” 王爱君表示,检查计划的制定并不简单。很多时候,产品的国外注册地址和放行地址并不在一个地方,需要把主要的生产环节确定下来,才能确定检查计划。
为防控进口产品风险,仅2017年国家食品药品监管总局在医疗器械领域,加大了对境外生产现场检查范围和力度,就先后对美国、德国等10个国家24家医疗器械生产企业的46个进口产品(含6个在审产品)开展境外生产现场检查,涉及骨科植入物、血管支架、吻合器、血管导管、敷料类产品和体外诊断试剂等。
2018年1月17日,国家食品药品监管总局官网公布了9家医疗器械企业境外生产现场检查结果。这是继2017年11月28日首次公布5家医疗器械企业境外生产现场检查结果后,国家食品药品监管总局公布的第3批检查结果。从检查结果看,上述企业主要分布在美国、欧洲等产业技术水平先进的国家和地区,其存在的缺陷和问题多涉及产品注册、厂房与设施、质量控制、工艺流程、采购、文件管理等方面;其中,有两家企业因存在违规行为,被叫停产品进口。
国家食品药品监管总局检查计划定下来后,检查员的确定也需要综合考虑多方面因素,“境外检查,检查员的资格、人员配置、检查方式方法,都与境内不一样。”王爱君告诉记者,一般每个品种或企业要检查4~5天,每组通常选派3~5名检查员,涵盖检测、注册、审评、体系检查等专业,有时还包括国家食品药品监管总局医疗器械注册管理司或医疗器械监管司的工作人员。
境外检查工作量大,专业要求高,面临很多突发状况,因此,对检查员来说是个不小的挑战。
2017年10月,中办、国办印发的《关于深化审评审批制度改革鼓励药品医疗器械产品创新的意见》(以下简称《意见》),对医疗器械监管检查事权提出了总体要求。
据了解,国家食品药品监管总局结合实际情况,在深入调研的基础上,科学设计了医疗器械监管检查事权划分制度,坚持根据各层级监管力量来分派监督检查任务,指导各地开展监督检查,重点加强境外生产企业的现场检查,确保检查任务不落空。
而为规范药品医疗器械境外检查工作,国家食品药品监管总局于2017年12月发布《药品医疗器械境外检查管理规定(征求意见稿)》,对药品医疗器械境外检查工作的总则、确定检查任务的流程、检查过程、审核及处理流程和原则,及相关附则、附件都做了明确规定。
加大医疗器械境外生产现场检查力度,一方面可以督促国外生产企业遵守中国医疗器械生产质量管理规范等相关法规,同时也锻炼了我国医疗器械检查员的国际检查能力和国际化水平。
但按照新的医疗器械监管事权划分,面对4000多家境外企业和每年上百家境内生产经营企业的飞行检查任务,靠现有的兼职检查人员是远不足以支撑的。
现阶段,国家食品药品监管总局医疗器械监管司将加快落实《意见》的要求,出台指导意见,推动建立国家和省级两级专职检查员队伍,培训具有高水平国际检查能力的检查员,争取早日实现对进口高风险医疗器械产品检查全覆盖的目标。
当前网址:http://www.gjymw.com/a/jyqxcp/2018/0222/6.html