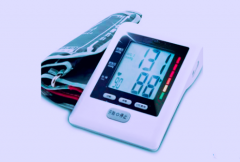
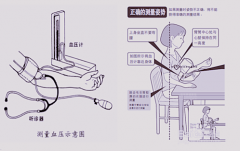
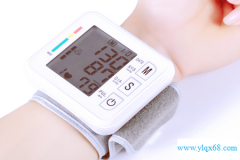
小编:医疗器械 电子血压计产品的研究生物相容性评价根据GB/T 16886.1标准进行,企业的申报资料应描述电子血压计所用材料及其与人体接触的性质,如:产品袖带(腕带)所采用的材料,与人体
医疗器械电子血压计产品的研究生物相容性评价根据GB/T 16886.1标准进行,企业的申报资料应描述电子血压计所用材料及其与人体接触的性质,如:产品袖带(腕带)所采用的材料,与人体接触为直接接触。生物相容性评价研究应给出实施或豁免生物学试验的理由和论证,并对现有数据或试验结果进行评价。建议电子血压计与患者接触部件至少考虑以下方面的要求:细胞毒性0级(或依据ISO10993.5—2009Biological evaluation of medical devices -- Part 5: Tests for in vitro cytotoxicity不超过2级);应无迟发型超敏反应;皮肤刺激应不大于1级。
3.4灭菌/微生物控制工艺研究
如产品声称具有无菌提供的部件,应提供灭菌工艺的研究资料。
3.5使用次数和包装研究
3.5.1使用次数的确定:应当提供产品寿命信息及确定依据。
3.5.2包装及包装完整性:应当提供产品包装的信息及确定依据,如产品声称具有无菌提供的部件,应提供在宣称的有效期内以及运输条件下,保持包装完整性的依据。
来源于:国际医美器械好品牌网
当前网址:http://www.gjymw.com/a/dzxyj/2018/0605/105.html