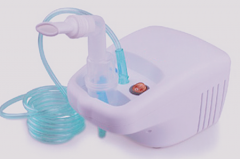
小编:家用 医用雾化器什么牌子好 它的研究要求是什么?雾化器研究要求分为以下六大方面: 1. 产品性能研究 应当提供产品性能研究资料以及产品技术要求的研究和编制说明,包括功能性、
家用医用雾化器什么牌子好它的研究要求是什么?雾化器研究要求分为以下六大方面:
1. 产品性能研究
应当提供产品性能研究资料以及产品技术要求的研究和编制说明,包括功能性、安全性指标(电气安全与电磁兼容)以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
1.1 应提供产品等效体积粒径分布的研究资料,包括实验方法及采用的原因。
1.2 应说明安全性能(包括电气安全与电磁兼容)研究及确定的依据。
1.3 对于吸嘴、吸入面罩、药液杯及其链接件,应说明其化学性能、微生物限度等确定的依据。
1.3 对于压缩式雾化器,还至少应说明气体流量、压力范围、喷雾速率等确定的依据。
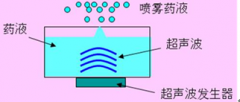
1.3 对于超声雾化器,还至少应说明最大雾化率、超声振荡频率确定的依据。
2. 生物相容性研究
应对与患者直接接触的吸嘴和吸入面罩材料的生物相容性进行评价。
生物相容性评价研究资料应当包括:
1)生物相容性评价的依据和方法。
2)产品所用材料的描述及与人体接触的性质。
3)实施或豁免生物学试验的理由和论证。
4)对于现有数据或试验结果的评价。
可参考《关于印发医疗器械生物学评价和审查指南的通知》(国食药监械〔2007〕345号),并依据GB/T16886.1—2011《医疗器械生物学评价 第1部分 风险管理过程中的评价与试验》标准对与患者直接接触的吸嘴、吸入面罩进行细胞毒性、刺激性、致敏的评价。
3. 灭菌/微生物控制工艺研究
与患者直接接触的吸嘴和吸入面罩使用前需经消毒或灭菌处理,并满足以下要求。
3.1生产企业灭菌:应明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并提供灭菌确认报告。
3.2终端用户灭菌:应当明确推荐的灭菌工艺(方法和参数)及所推荐的灭菌方法确定的依据。
3.3残留毒性:如采用环氧乙烷灭菌,应当明确残留物信息及采取的处理方法,并提供研究资料,企业需提供保证产品出厂时环氧乙烷残留量不得大于10μg/g的处理方法。
3.4终端用户消毒:应当明确推荐的消毒工艺(方法和参数)以及所推荐消毒方法确定的依据。
4. 有效期和包装研究
4.1 有效期的确定:可分为“主机”和“吸嘴、吸入面罩”两部分说明,且均应提供产品使用期限的验证报告。
4.2 主机使用期限的验证可依据具有固定使用期限的主要元器件(如压缩式雾化器的压缩机、超声雾化器的超声换能器)的情况进行详细描述,来作为产品主机使用期限或者产品失效期的具体理由,并给出产品主机使用期限或者失效期。
4.3 若吸嘴和吸入面罩可重复使用,应当提供使用次数验证资料;若吸嘴和吸入面罩为一次性使用无菌产品,应当提供产品有效期的验证报告。
5. 软件研究
申请人应根据《医疗器械软件注册技术审查指导原则》的要求提交软件研究资料。
6.药物相容性研究
医用雾化器应对与雾化前后药液/雾接触的部件与可雾化药物的相容性进行研究。
来源于:国际医美器械好品牌网
当前网址:http://www.gjymw.com/a/yywhq/2019/0910/543.html